Anwenderbericht
Falldokumention
26.10.21
Neues Verfahren zur Herstellung von autologem plättchenreichem Plasma
Regeneration mit A-PRP: effizient die Heilung beschleunigen
Die innovative Technologie und Forschungsarbeit des Schweizer Unternehmens Regen Lab S.A. ermöglicht es erstmals durch den Einsatz von plättchenreichem Plasma (A-PRP), sowohl die Effizienz im Praxisalltag des Zahnarztes als auch seinen Behandlungserfolg deutlich zu verbessern.
Bereits in den 90er-Jahren wurde plättchenreiches Plasma in der Zahnmedizin eingesetzt. Ziel war es, mithilfe der Thrombozyten (Blutplättchen) sowie zahlreichen Wachstumsfaktoren weniger Wundschmerz, geringere Infektionsneigung bei der Behandlung sowie schnellere Wundheilung und Knochenaufbau zu erreichen. Der Herstellungsprozess von plättchenreichem Plasma war damals noch komplex und nicht standardisiert. Man benötigte größere Mengen an Blut (20 bis 500 ml), dem ein Antikoagulans zugesetzt wurde, um den flüssigen Zustand des Plasmas auch nach der Zentrifugation zu gewährleisten. Die zeitaufwendige, zweistufige Zentrifugation zur Trennung der Blutbestandteile verbunden mit variierenden Konzentrationen der Thrombozyten im Plasma galt lange als wesentlicher Nachteil dieser Methode. Das Verfahren eignete sich nur bedingt für den Einsatz im Praxisalltag.
Das heute weit verbreitete plättchenreiche Fibrin (PRF) wird im Gegensatz dazu ohne Zugabe eines Antikoagulans zentrifugiert, was dazu führt, dass das Blut während oder kurz nach der Zentrifugation koaguliert und als feste Fibrinmatrix vorliegt. Die Thrombozyten verteilen sich je nach Zentrifugationsprotokoll unterschiedlich in der Fibrinmatrix, was zu plättchenarmen Fibrin führen kann.
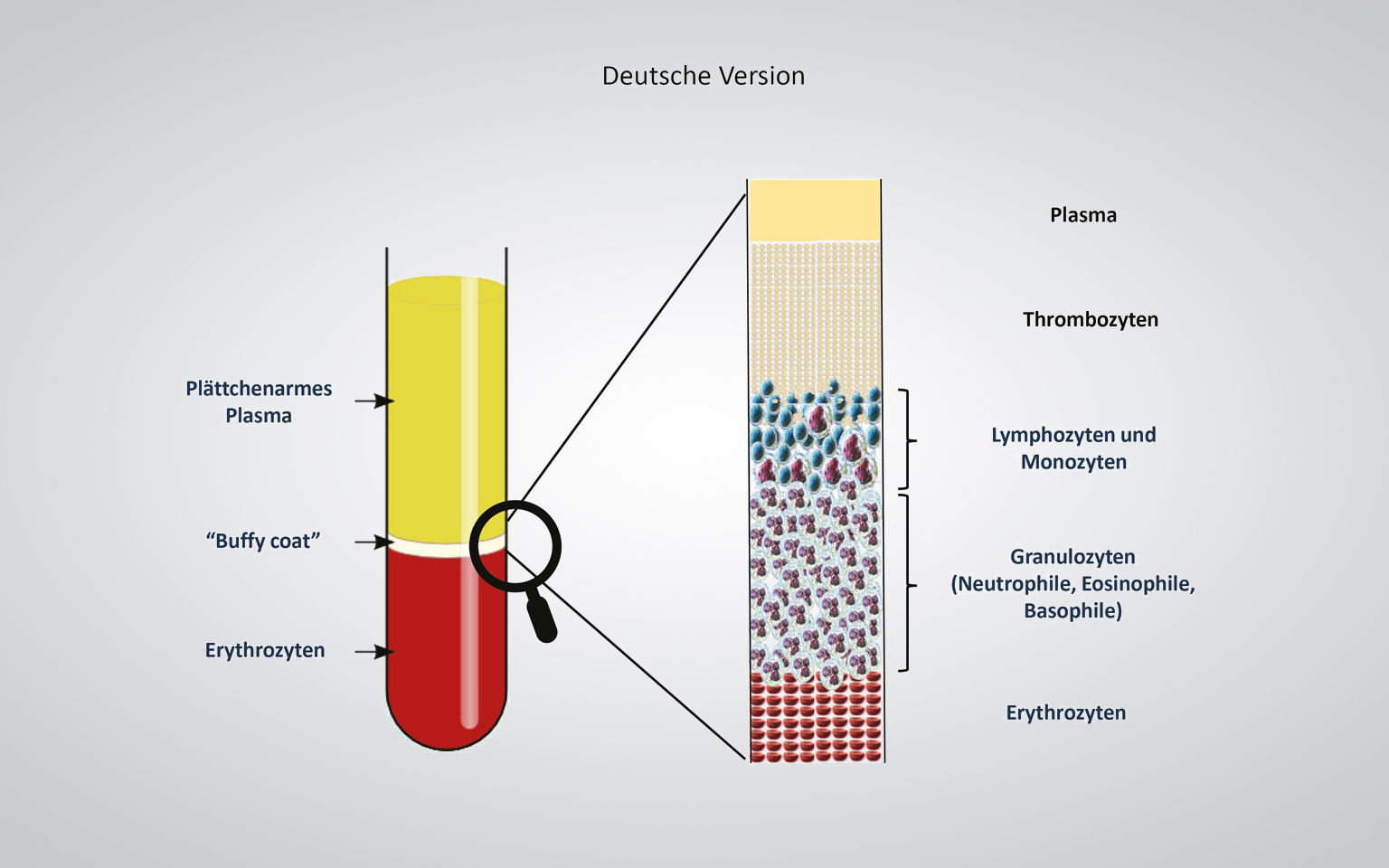
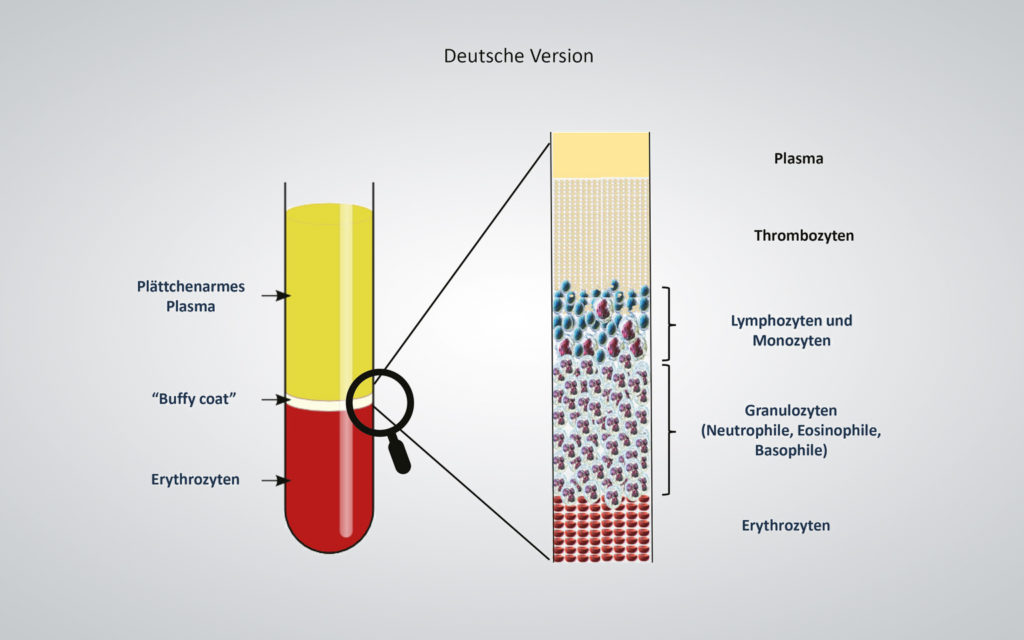
Das flüssige plättchenreiche Plasma (PRP) wiederum bietet den maßgeblichen Vorteil, dass die Inhaltsstoffe des Bluts gezielt separiert werden können. Dies gilt insbesondere für die heilungsfördernden Bestandteile des „Buffy Coat“ – Monozyten, Lymphozyten und Thrombozyten. Der „Buffy Coat“ ist nur wenige Millimeter dick und befindet sich nach der Zentrifugation zwischen Plasma und roten Blutkörperchen.
Neues effizientes Herstellungsverfahren
Die innovative Regen Lab-Technologie setzt im Herstellungsverfahren an und mildert damit frühere Nachteile ab. Eine nur noch geringe Blutmenge wird zusammen mit dem physiologischen Antikoagulans und einem thixotropen, bioinerten Trenngel einmalig zentrifugiert. Das Trenngel separiert entsprechend seiner spezifischen Dichte während der Zentrifugation die entzündungsfördernden Erythrozyten und Granulozyten nahezu vollständig von den heilungsfördernden Bestandteilen des Bluts [19, 1]. Das Ergebnis ist ein plättchenreiches und leukozytenreduziertes Plasma. Das optimale Zellprofil enthält sowohl große als auch kleine Thrombozyten, Monozyten und Lymphozyten vollständig gelöst und homogen verteilt. Der Herstellungsprozess des A-PRP ist standardisiert und damit reproduzierbar. Die Konzentration an Thrombozyten im Plasma ist damit nicht abhängig vom Anwender oder unterschiedlichen Zentrifugationsprotokollen. Der Prozess findet in einem geschlossenen und sterilen „One-step-closed“-System statt, zugelassen als Medizinprodukt der Klasse 2b. Das garantiert die Sicherheit für Patient und Anwender.
Grundlagen
Die Medizin setzt zunehmend auf die Verwendung von körpereigenen regenerativen Verfahren, bei denen wachstumsfaktorreiche Lösungen eine entscheidende Rolle spielen. Als plättchenreiches Plasma (PRP) wird das autologe Thrombozytenkonzentrat bezeichnet, das im Plasma gelöst ist und aufgrund seiner besonderen Inhaltsstoffe eine zentrale Rolle bei der Steuerung der Wundheilung und der Regeneration von Hart- und Weichgewebe spielt [12]. Typische Anwendungsbereiche stellen Therapien von Arthrose, Tendinitis, Knochendefekten und anderen Weichteilverletzungen dar [10]. Dieses nachfolgend thematisierte biologische Prinzip kann auch auf die Zahnheilkunde übertragen werden [17, 5, 2].
Plättchenreiches Plasma enthält Fibrinogen und andere Gerinnungsmoleküle im Überfluss, gefolgt von einer Vielzahl an essenziellen Zellnährstoffen, bioaktiven Molekülen und einer konzentrierten Zahl an Thrombozyten. Diese setzen Wachstumsfaktoren, Zytokine und Chemokine frei [3, 15], die wichtige physiologische Zellaktivitäten steuern, proliferative sowie chemotaktische Funktionen ausüben – mit Wirkung auf Stammzellen und Fibroblasten – und damit die Steuerung der Wundheilung und die anschließende Geweberegeneration unterstützen [15, 13].
Die Blutplättchen produzieren die zuvor angesprochenen bioaktiven Moleküle und speichern diese in ihren intrazellulären ‑Granula [6]. Diese Wachstumsfaktoren und Zytokine werden bei der Aktivierung der Thrombozyten gezielt freigesetzt [15]. Jedoch werden auch noch nach der initialen Aktivierung und ersten Freisetzung innerhalb des Lebenszyklus der Thrombozyten weitere Wachstumsfaktoren produziert [12]. Einige dieser Schlüsselproteine sind Platelet-derived Growth Factors (PDGF), Transforming Growth Factors – 1 (TGF), Fibroblast Growth Factors (FGB), Epithelial Growth Factors (EGF), Insulin-like Growth Factors-1 (ILF-1), jedoch stellt dies nur einen kleinen Teil der Moleküle dar, die von den Thrombozyten abgesondert werden [6].
Durch die Verwendung von Regen Lab A-PRP können dem zu regenerierenden Gewebe wichtige Biomoleküle bereitgestellt werden, die es ermöglichen, die für die verschiedenen Heilungsphasen benötigte Zeit zu reduzieren [19]. Im Regen Lab A-PRP liegen Thrombozyten aller Lebenszyklen – sowohl „junge“ als auch „alte“ Thrombozyten – vor. Die Thrombozyten besitzen im zirkulierenden Blut eine mittlere Lebensdauer von bis zu zehn Tagen, jedoch kann die biologische Wirkung von PRP nach Aktivierung bis zu 15 Tage anhalten [7]. Innerhalb dieses Zeitraums werden weitere Wachstumsfaktoren von den intakten Thrombozyten produziert und freigesetzt [12].
Der Konzentrationsfaktor der Thrombozyten im Regen Lab A-PRP liegt bei 1,6, was dem optimalen physiologischen Faktor entspricht. In Studien konnte nachgewiesen werden, dass plättchenreiches Plasma mit niedrigeren Thrombozytenkonzentrationen – 1- bis 3-fache Basislinie – robustere Heilungsraten als die mit höheren Konzentrationen von 3‑bis 8-facher Basislinie zeigen [14]. „Die Verwendung von hochkonzentrierten Thrombozytenpräparaten schien einen hemmenden Einfluss auf die Osteoblastenaktivität zu haben. Möglich Gründe könnten unerwünschte hemmende und zytotoxische Wirkungen von Wachstumsfaktoren in so hohen Konzentrationen sein“ [18, 4].
Herstellung
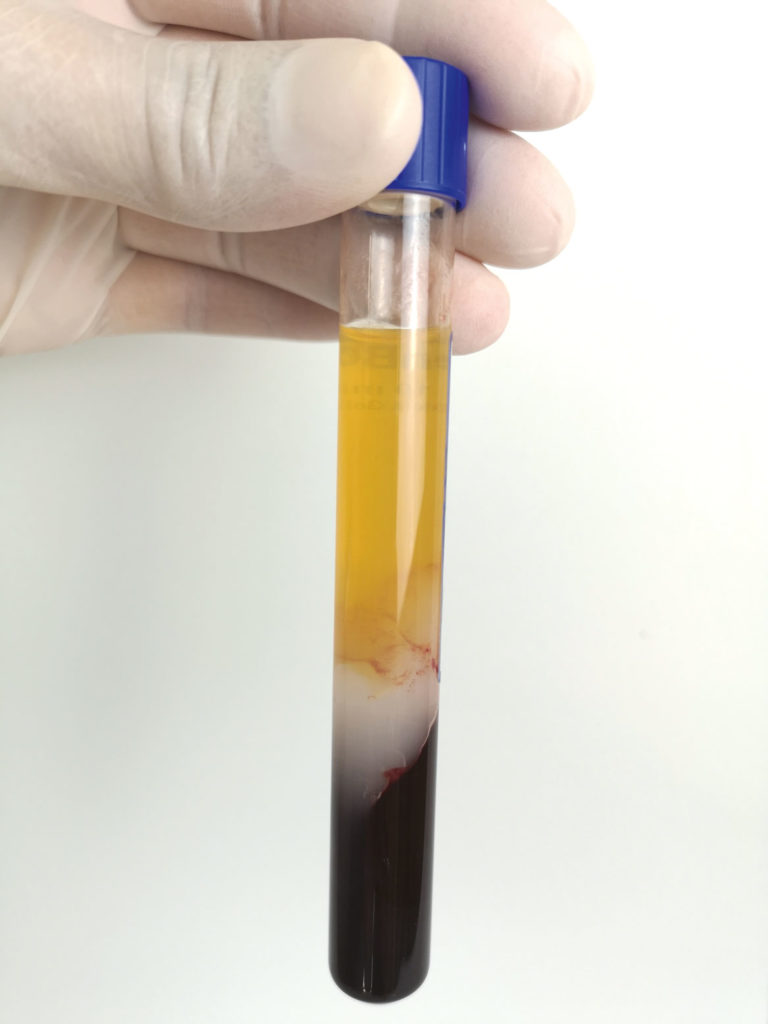
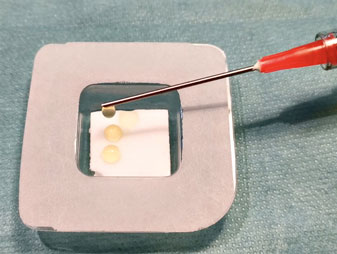
Mithilfe eines Standard-Blutentnahmesystems (BD Vacutainer) wird das Patientenblut (10 ml) zellschonend in das geschlossene System des Medizinprodukts überführt, dessen Zweckbestimmung die Herstellung von autologem Thrombozytenkonzentrat ist. Die einmalige Zentrifugation zur Trennung der Blutbestandteile dauert fünf Minuten und erfolgt in einer dafür programmierten Zentrifuge. Ausschlaggebend für die Trennung der Blutbestandteile ist deren unterschiedliche Dichte. Die schwersten Blutbestandteile, die Erythrozyten, finden sich am Boden des Medizinprodukts, darüber die leichtere Leukozytenschicht (engl. Buffy Coat), gefolgt von den Thrombozyten und zuletzt dem Blutplasma (Abb. 1). Das zuvor in einer festen Form vorliegende Trenngel wird aufgrund der in der Zentrifuge auftretenden Scherkräfte flüssig (thixotrop). Entsprechend seiner eigenen Dichte positioniert sich das Trenngel dann oberhalb der unerwünschten Erythrozytenfraktion und der entzündungsfördernden Granulozyten. Eine physikalische Trennung entsteht dadurch, dass das Gel nach der Zentrifugation aushärtet und wieder seinen festen Zustand annimmt. Nach Durchmischen (Resuspension) befinden sich oberhalb des Trenngels sowohl über 80 Prozent der Thrombozyten als auch Anteile von Mono- und Lymphozyten vollständig im flüssigen Plasma gelöst (Abb. 2) [19, 1]. Der Wert bleibt nachweislich bis vier Stunden nach der Zentrifugation (T = 0/T = 4) nahezu unverändert. Das mittlere PRP-Volumen aus 10 ml Blut beträgt 5,6 ml.
Das mit dem Regen BCT-Medizinprodukt hergestellte PRP weist eine sehr niedrige Kontamination an roten Blutkörperchen auf. Diese werden zu 99,7 Prozent entfernt.
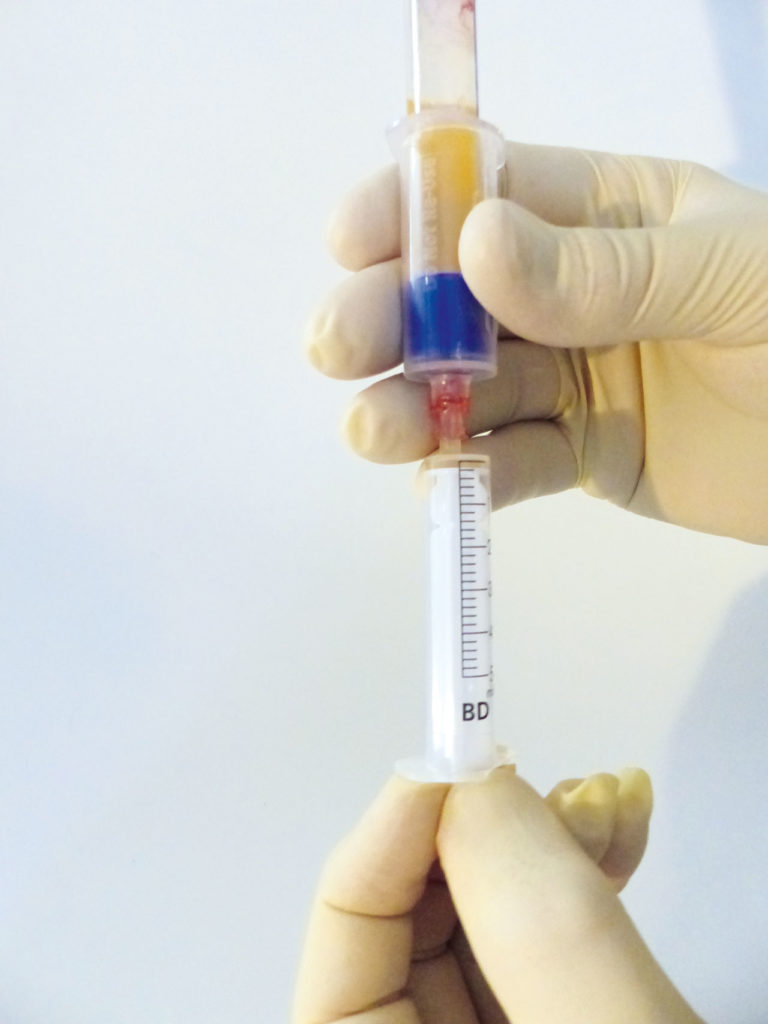
Der Leukozytenspiegel wird drastisch gesenkt, mit einer Abnahme von 96,7 Prozent der proinflammatorischen Granulozyten. Die verbleibenden weißen Blutkörperchen bestehen hauptsächlich aus Lymphozyten und Monozyten. Das flüssige Plasma mit den Thrombozyten und den Leukozyten kann nun aus dem geschlossenen System mithilfe eines Transferadapters in eine Spritze aufgezogen und anschließend sofort steril verwendet werden (Abb. 3). Mit diesem standardisierten Prozess wird ausgeschlossen, dass aufgrund von möglichen Anwenderfehlern erhöhte Konzentrationen an entzündungsfördernden Blutbestandteilen (Granulozyten und Erythrozyten) im Endprodukt vorkommen, die dem gewünschten heilungsfördernden Effekt des PRP entgegenwirken würden.
Anwendung
Das plättchenreiche Plasma liegt zunächst in flüssiger Form vor, kann aber in weitere Aggregatzustände überführt werden (flüssig und gelförmig). Damit wird der Einsatz für eine ganze Reihe zahnmedizinischer Indikationen ermöglicht wie beispielweise:
Weichgewebeheilung:
Rezessionsdeckung/Tunneltechnik
Periimplantäres Weichgewebemanagement
Hartgewebeaufbau:
Alveolare Socket Preservation
Sinuslift mit/ohne Knochenersatzmaterial
Knochenkamm-Augmentation
(vertikal/horizonztal)
Verbesserung der Ossointegration
Wurzelspitzenresektion
Das flüssige A-PRP kann für die Gewebeinjektion zur Unterstützung der Wundheilung (Einspritzen in die Wundränder) oder für das Anfeuchten und damit Einbringen regenerativer Anteile in Knochenersatzmaterialien oder kollagenbasierte Biomaterialien verwendet werden (Abb. 4 und 5) [2, 17, 5]. Wird das flüssige A-PRP gezielt mit Kalziumglukonat aktiviert, kann in einem sterilen Gefäß eine stabile Fibrinmembran ähnlich der PRF-Membran erzeugt werden. Zunächst bildet sich ein Fibrinclot, der das Plasma mit den darin gelösten essenziellen Zellnährstoffen und Wachstumsfaktoren ausschüttenden Thrombozyten enthält ( Abb. 6). Auch die Membran weist aufgrund des Trenngelsystems äußerst geringe Anteile an Erythrozyten (0,3 %), eine reduzierte Leukozytenkonzentration und eine immer gleichmäßige Verteilung der Thrombozyten über die gesamte Membran hinweg auf. Nach der Aktivierung der Thrombozyten werden diese in der dreidimensionalen Fibrinmarix eingeschlossen (Abb. 7).
Falldokumentation: Rekonstruktion einer Freiendsituation mittels partikulären Knochenersatzmaterials und plättchenreichen Plasmas (PRP)
Die Rekonstruktion des Kieferknochens, sowie die simultane oder spätere Insertion dentaler Implantate gehören schon längst zum Alltag in der Zahnmedizin. Immer häufiger ist es der Patient, der mit dem ausdrücklichen Wunsch nach festsitzendem Zahnersatz in die Praxis kommt und dafür auch bereit ist, mehrere chirurgische Interventionen auf sich zu nehmen. Bei jedem Eingriff gilt es, die Voraussetzungen und Möglichkeiten neu zu definieren. Trotz der Einführung von längen- und durchmesserreduzierten Implantaten ist in den meisten Fällen eine Augmentation notwendig, um die optimalen Voraussetzungen für ein suffizientes Implantatlager zu schaffen. Dabei ist es wichtig, die Gegebenheiten sowie notwendige unterstützende Maßnahmen bei der Wundheilung zu berücksichtigen.
Gerade bei schwierigen und ausgeprägten Knochendefekten ist ein Maximum an regenerativem Potenzial notwendig, um den gewünschten Erfolg zu erzielen. Dazu kann und soll das autologe plättchenreiche Plasma mit seiner vielseitigen Anwendbarkeit einen Beitrag leisten und wird in dem dargestellten Patientenfall beschrieben. Diese neue Indikation bei der Anwendung des autologen Plasmas, in Kombination mit einer partikulären Augmentation (GBR) dient nicht nur der Verbesserung der Wundheilung und der knöchernen Integration, sondern stellt bei der Anwendung aufgrund der Formbarkeit des Augmentats eine ganz neue Alternative dar, Knochendefekte zu rekonstruieren.
Ausgangssituation
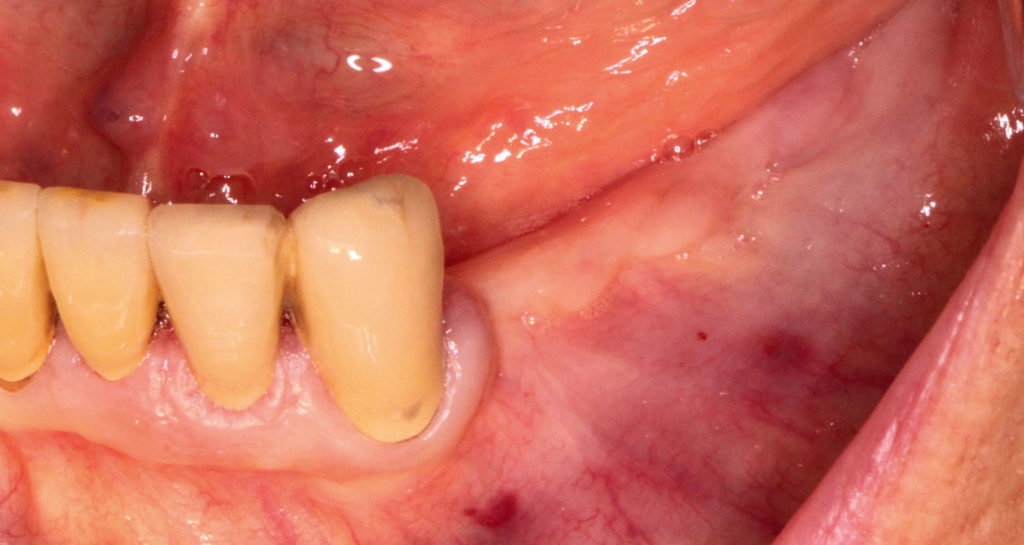
Der 83-jährige Patient wurde von seiner Hauszahnärztin in unsere Implantatsprechstunde überwiesen. Der Patient war allgemeinanamnestisch unauffällig. Er nahm ASS 100 aufgrund eines vorangegangenen leichten Infarkts im Jahr 2003 ein. Die Zähne 34 bis 37 sowie 42 und 43 wurden alio loco entfernt.
Die Verwendung von autologem plättchenreichem Plasma gewinnt gerade im Bereich der Implantologie immer mehr an Bedeutung. Die Vorteile liegen auch klar auf der Hand. Um die primäre Abheilung des Hart- und Weichgewebes zu beschleunigen und zu verbessern, nutzt man die wundheilungsfördernde Eigenschaft aus dem Blut bei chirurgischen Eingriffen. Durch die Mischung des flüssigen PRP mit dem partikulären Augmentat, nutzt man das enorme Potenzial des Plasmas, um das Kochenersatzmaterial nicht nur biologisch, sondern auch mechanisch zu stabilisieren. Beschrieben wurde dieses Verfahren auch schon unter der Bezeichnung „Kieler Sushi-Konzept.“
Chirurgisches Vorgehen
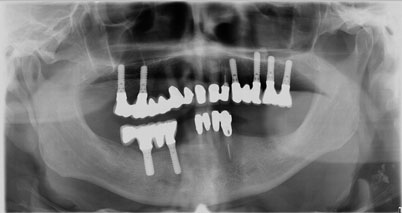
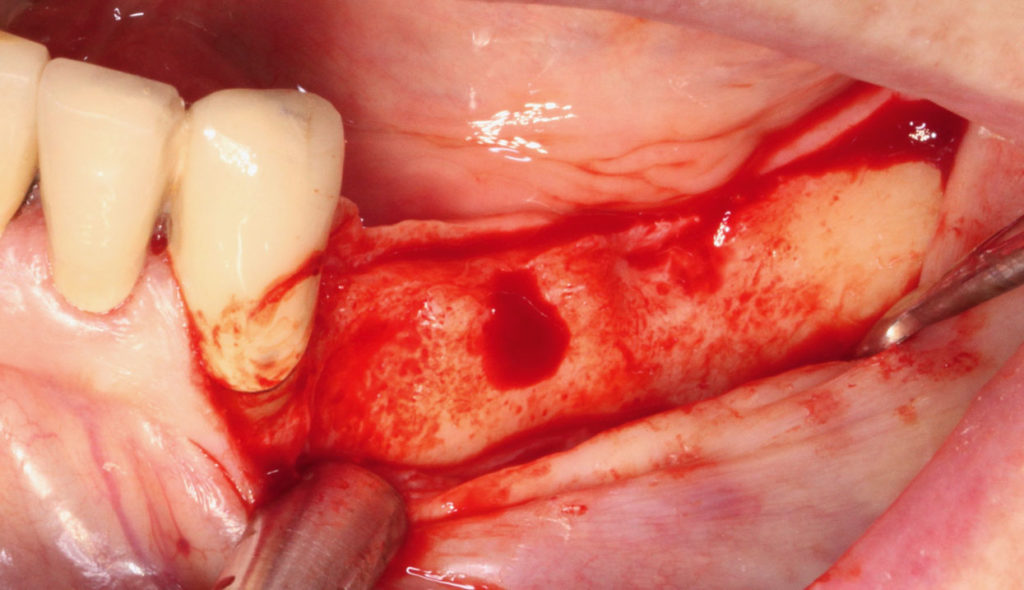
Zur genauen Planung der notwendigen Rekonstruktion im Bereich des lateralen Unterkiefers (III. Quadrant, regio 34, 37), wurde eine Panoramaschichtaufnahme (OPG) angefertigt (Abb. 8). Es zeigte sich ein dreidimensionaler Defekt, der jedoch aufgrund des stabilen lingualen Knochenanteils die Entscheidung für eine partikuläre Augmentation zuließ. Das umgebende Weichgewebe war suffizient und vom Phänotyp dick (Abb. 9). Die krestale Schnittführung erfolgte in Intubationsnarkose, wobei ein Mukoperiostlappen präpariert wurde. Auf eine vertikale Entlastung wurde verzichtet, da die Schnittführung weit nach distal verlagert wurde (Abb. 10).
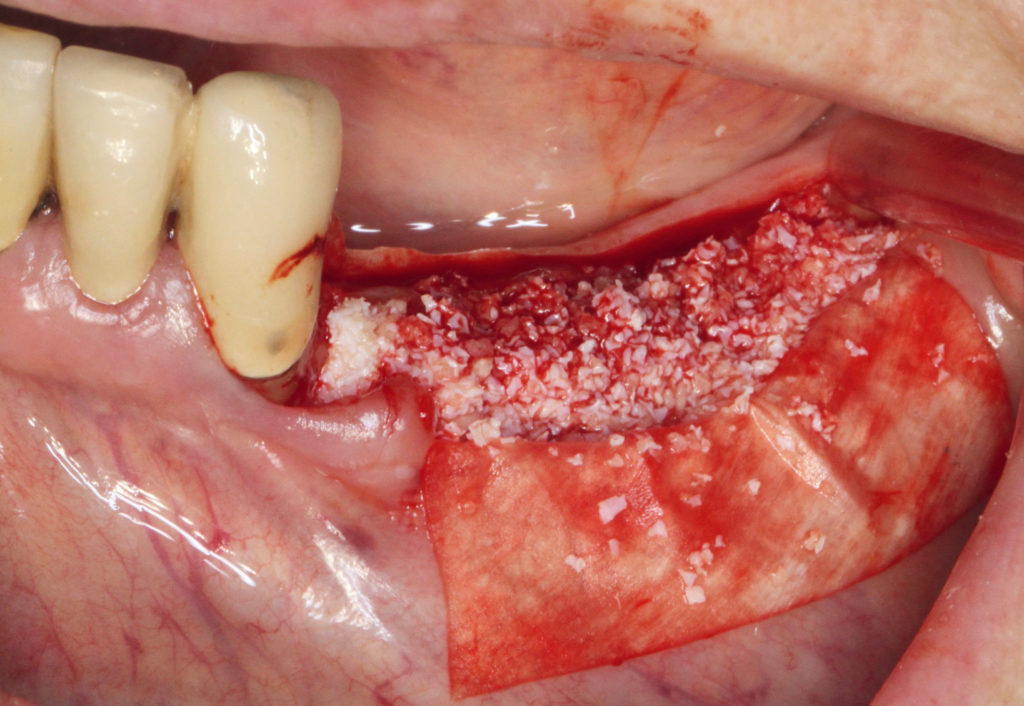
Dennoch wurde im bukkalen wie auch im lingualen Lappenanteil eine Periostschlitzung durchgeführt, um den Volumenzuwachs und einen sicheren Nahtverschluss zu gewährleisten. Nach dem Anfrischen des Transplantationslagers mittels einer Kugelfräse im gesamten Augmentationsgebiet regio 34 bis 37 erfolgte die partikuläre Augmentation mit einem Gemisch aus 75 Prozent allogenem Knochenersatzmaterial (maxgraft, Botiss Biomaterials) und 25 Prozent bovinem Knochenersatzmaterial (Bio-Oss, Geistlich Biomaterials). Das partikuläre Gemisch wurde mit dem gewonnenen Plasma aus dem zentrifugierten Blut des Patienten nach Aktivierung mit Kalziumglukonat vermischt. Innerhalb von zehn Minuten geht das Gemisch von leicht klebrig in den festen Zustand über. In dieser Zeit konnte das Augmentat in der gewünschten Form und Position perfekt adaptiert werden (Abb. 11).
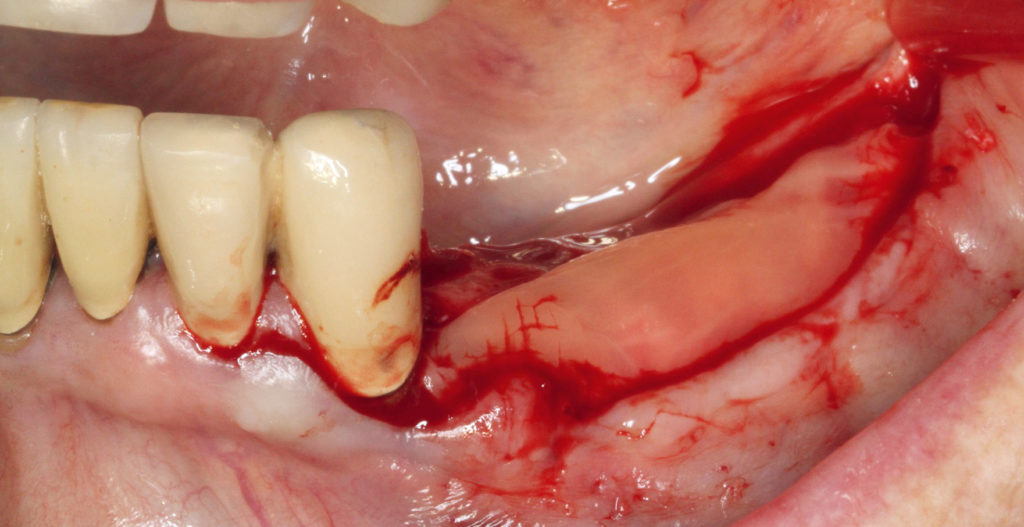
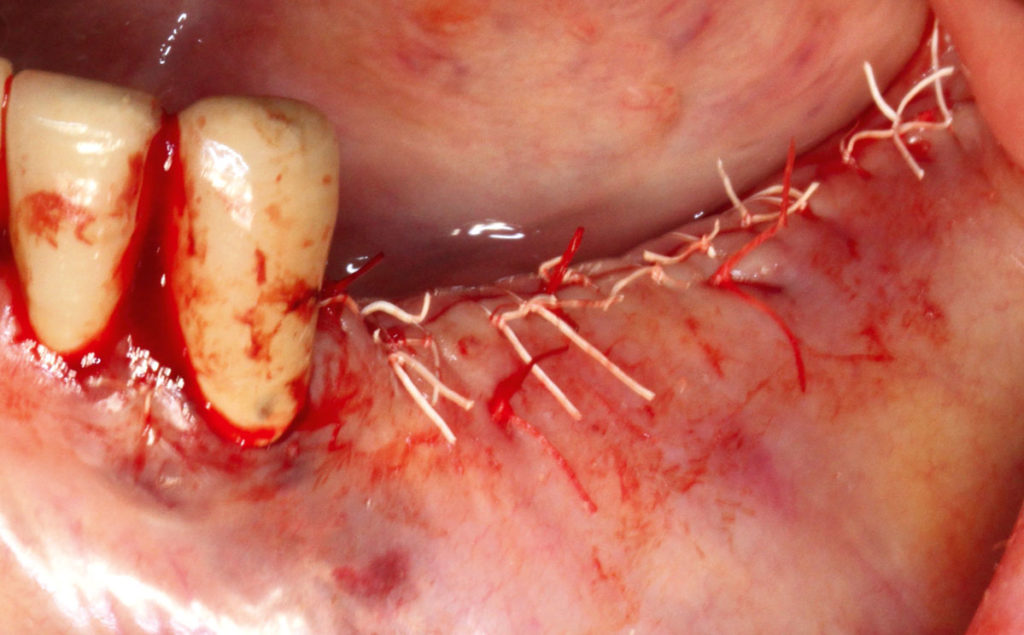
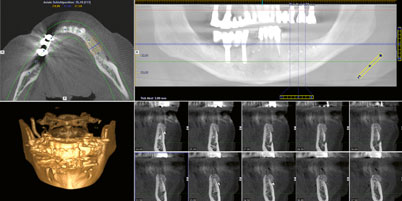
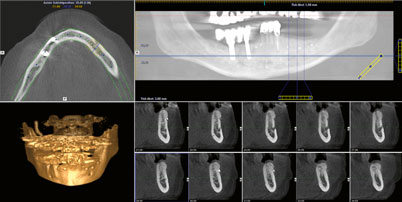
Zur Abdeckung der Augmentation kam eine resorbierbare porcine Pericard-Membran zum Einsatz (Jason, Botiss Biomaterials). Diese wurde zuvor in das flüssige Plasma eingelegt und rehydriert. Die Membran wurde mit Spikes basal fixiert. Als finales Layer vor dem Nahtverschluss wurde eine PRP-Membran, die ebenfalls aus dem flüssigen Plasma unter Zugabe von Kalziumglukonat gewonnen wurde, direkt als Auflage auf der Pericard-Membran positioniert (Abb. 12). Der spannungsfreie Nahtverschluss wurde in zwei Schichten mit einem resorbierbaren Nahtmaterial (Vicryl rapid 5.0) realisiert, indem mit einer horizontalen Rückstichnaht und krestal mit doppelt liegenden horizontalen Nähten (Gore Tex 5.0) gearbeitet wurde (Abb. 13). Die restlichen Anteile des flüssigen Plasmas wurden nach dem Nahtverschluss zirkulär um das Operationsgebiet eingespritzt. Postoperativ wurde ein digitales Volumentomogramm (DVT) angefertigt, um die volumetrische Veränderung im Augmentationsbereich überprüfen zu können (Abb. 14). Die Wundheilung zeigte sich über den gesamten Verlauf unauffällig, Fäden konnten zeitgerecht entfernt werden, und der Patient war nahezu ohne Schwellung in den ersten sowie den postoperativen Tagen.
Reentry zeigte vitales Augmentat
Nach fünf Monaten erfolgte eine erneute DVT-Aufnahme. Dabei zeigten sich eine erfolgreiche Rekonstruktion des Alveolarfortsatzes und eine sehr gute Ortsständigkeit des Augmentats (Abb. 15). Somit konnte das Reentry in Lokalanästhesie unmittelbar nach der röntgenologischen Kontrolle durchgeführt werden.
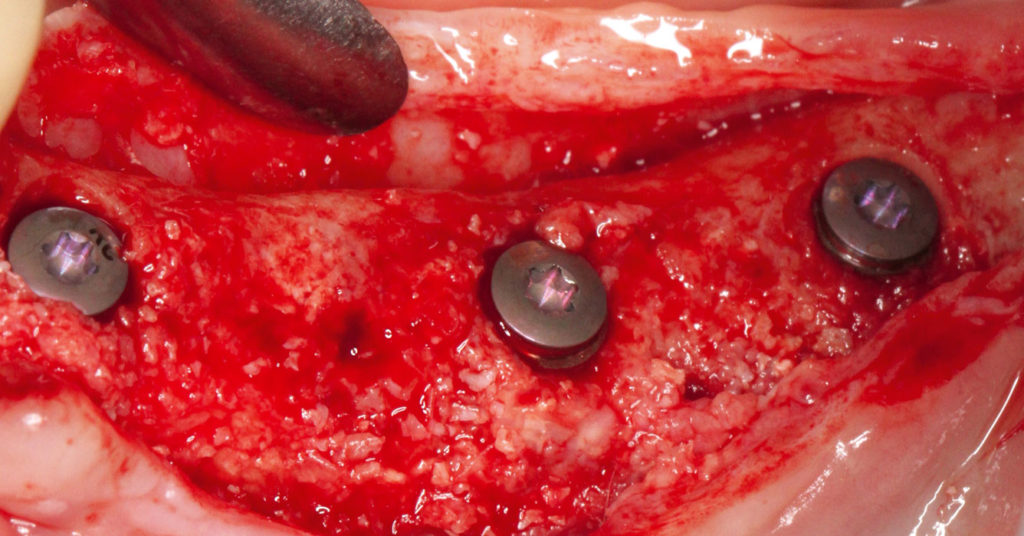
Nach Präparation des Mukoperiostlappens und Darstellung des Kieferkamms konnte auch die klinisch gute und vitale Integration des Augmentats festgestellt werden. Deutlich zu sehen waren noch Reste des Knochenersatzmaterials – die Pericard-Membran war jedoch bereits vollständig resorbiert. Die Festlegung der exakten Implantatpositionen konnte durch die Verwendung einer Bohrschablone gewährleistet werden. Zusätzlich wurden an diesen festgelegten Positionen Trepanbohrungen durchgeführt, um die Knochenneubildung histologisch untersuchen zu können. Das Implantatbett selbst wurde nach dem Bohrprotokoll der Firma Straumann für Bone Level Implantate aufbereitet. Die drei Implantate wurden in regio 34, 36, 37 (Straumann Bone level 4,1 x 10 mm) maschinell mit einer Primärstabilität von 45 Ncm eingebracht (Abb. 16). Die röntgenologische Kontrolle der gesetzten Implantate wurde mittels OPG durchgeführt (Abb. 17). Mit Einzelknopfnähten (Prolene 6.0) wurde der erneute Wundverschluss gewährleistet, und der postoperative Heilungsverlauf war erneut unauffällig.
Biopsien und Freilegung
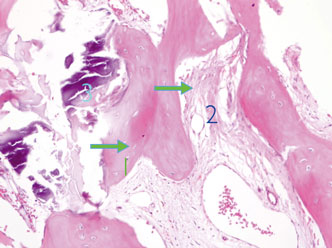
Die Biopsien aus den Trepanbohrungen zeigten eine gute Umwandlung und Integration des eingebrachten Knochens im Bereich des Bohrstollens der Implantate (Abb. 18). Es konnte ein histologisch ausgewerteter Anteil von neugebildetem Knochen zwischen 50 und 90 Prozent festgestellt werden.
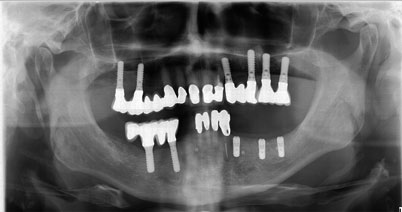
Die Freilegung der Implantate erfolgte nach weiteren drei Monaten und zeigte eine stabile und gute Osseointegration der inserierten Implantate im OPG (Abb. 19). Zusätzlich wurde der Implantatstabilitätsquotient (ISQ, Osstell Beacon) gemessen, der zu dem Zeitpunkt der Freilegung bei weit über 70 lag.
Fazit
Nach den klinisch-praktischen Erfahrungen in unserer Praxis stellt das plättchenreiche Plasma (PRP) eine in vielen Indikationen sichere und vielversprechende Option dar. Die Stabilisierung eines partikulären Knochenersatzmaterials mit PRP ist eine effiziente Unterstützung bei bereits bekannten, herkömmlichen Augmentationsverfahren. Die vielseitige Anwendbarkeit des gewonnenen Plasmas in flüssiger, fester und auch plastischer Form vergrößert das Spektrum enorm und unterstützt somit in allen Bereichen das eingebrachte Augmentat. Eine endgültige, evidenzbasierte Aussage bezüglich der Überlegenheit dieses Verfahrens ist derzeit aufgrund der fehlenden Studien nur eingeschränkt möglich.
Literaturverzeichnis unter
www.teamwork-media.de/literatur
| Produkt | Produktname | Firma |
| Implantate | Bone Level | Straumann |
| KEM, allogen | CHB | Botiss Biomaterials |
| KEM, bovin | Bio-Oss | Geistlich Biomaterials |
| Pericard-Membran, porcin | Jason | Botiss Biomaterials |
| Messgerät Primärstabilität | ISQ | Osstell |
| A-PRP | RegenKit BCT | Regen Lab S.A. |
| OP-Besteck | A-PRP Set | Sanafirst Medizintechnik |
Anwenderbericht
Weitere Beiträge zum Thema