Fachbericht
Implantologie & Parodontologie
21.10.21
Wie hoch ist der klinische Evidenzgrad?
15 Jahre Anwendung von Platelet-Rich Fibrin in der Zahnmedizin und der Kieferchirurgie
Biomaterialien, PRF, Regeneration, Wundheilung, Zentrifugalkraft
Platelet-Rich Fibrin (PRF) ist ein autologes Blutkonzentrat. In den vergangenen 15 Jahren wurde PRF in unterschiedlichen Indikationen in der der Regenerativen Zahnmedizin, insbesondere der Implantologie, verwendet. In dem Beitrag präsentieren die Autoren die Ergebnisse einer systematischen Übersichtsarbeit, um die vorhandene klinische Evidenz zu evaluieren. Zusätzlich stellen sie standardisierte klinische Protokolle vor, gemäß deren Kliniker einheitliche klinische Daten erheben können.
Fragen an die Autoren
Wie wird das Platelet-Rich Fibrin (PRF) hergestellt?
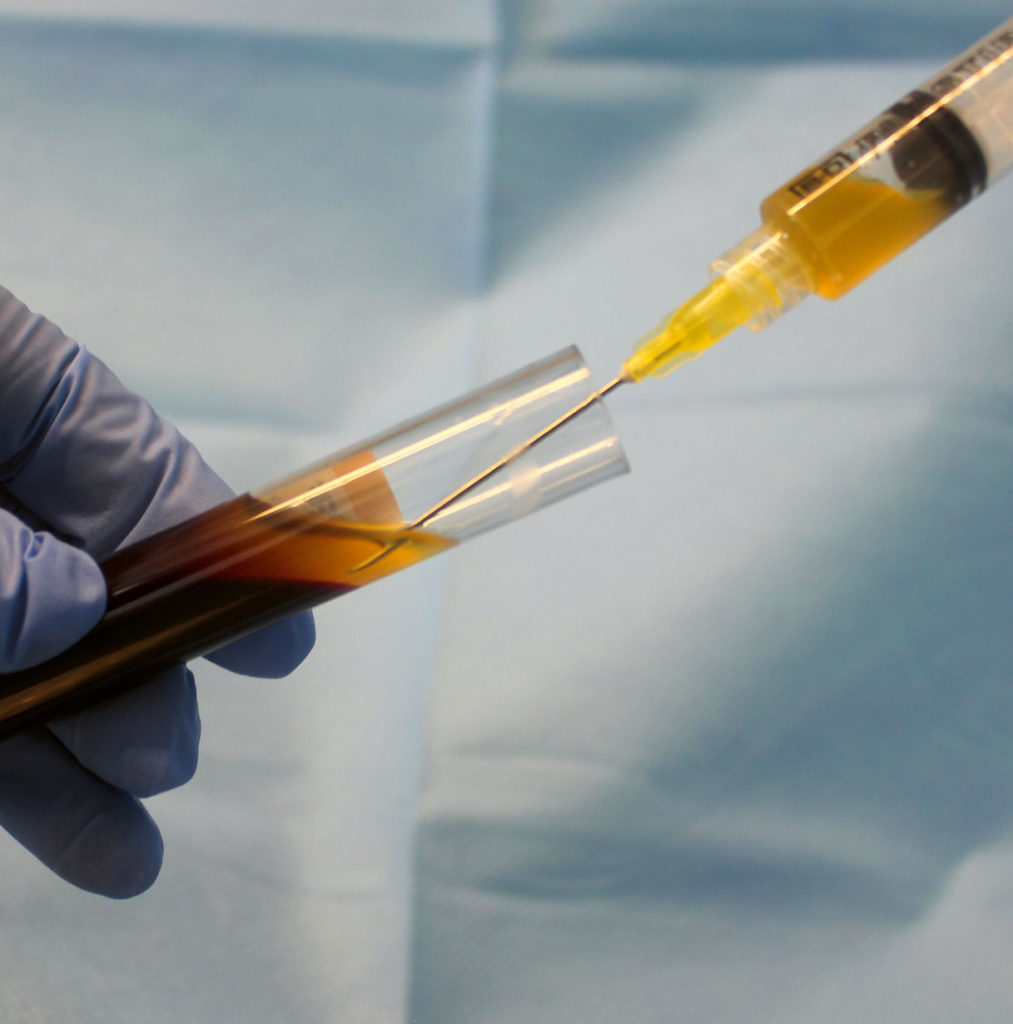
Prof. Dr. mult. Shahram Ghanaati: Mit einer einfachen Blutentnahme aus der peripheren Armvene wird das Blut entnommen und nach standardisierten Zentrifugationsprotokollen gemäß dem Low Speed Centrifugation Concept (LSCC) zentrifugiert. Dabei können sowohl feste als auch flüssige PRF-Matrizes ohne die Zugabe von Antikoagulanzien hergestellt werden.
Für welche Indikationen eignet sich der Einsatz von PRF in der Implantologie?
PRF als bioaktives autologes Konzentrat kann für die Unterstützung der Wundheilung und der Regeneration verwendet werden. PRF kann keinesfalls als Ersatz für Biomaterialien betrachtet werden. Vielmehr soll PRF als eine Matrix gesehen werden, die die Regeneration, zum Beipsiel im Rahmen von Socket Preservation, Sinuslift oder von dreidimensionaler Augmentation, unterstützen und beschleunigen kann.
Neben restaurativen Methoden tragen regenerative Maßnahmen in der Zahnmedizin und der Mund-, Kiefer- und plastischen Gesichtschirurgie (MKPG) in unterschiedlichen Indikation entscheidend zum Behandlungserfolg bei. Vor allem in der Parodontologie und der Implantologie sind regenerative Methoden etabliert. Dabei sind je nach Indikation die chirurgische Technik, die Knochentransplantation sowie die minimalinvasive biomaterialbasierte Regeneration von großer Bedeutung.
Eine weitere Alternative, die sowohl minimalinvasiv ist als auch autolog gewonnen werden kann, sind Blutkonzentrate. Diese werden aus dem patienteneigenen peripheren Blut hergestellt. Grundsätzlich werden bei allen Blutkonzentraten Blutbestandteile durch Zentrifugation getrennt beziehungsweise in Phasen konzentriert. Das Hauptziel liegt darin, patienteneigene Blutbestandteile und deren Wachstumsfaktoren zu verwenden, um Wundheilung und Regeneration zu unterstützen [1].
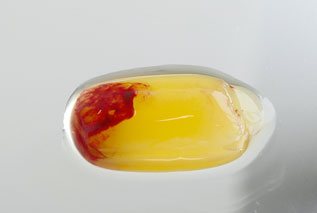
In 2001 wurde das sogenannte Platelet-Rich Fibrin (PRF) erstmals beschrieben [2]. PRF ist das einzige Blutkonzentrat, das ohne jegliche externe Zusätze wie Antikoagulanzien, in zwei unterschiedlichen Formen, das heißt flüssige und/oder solide Matrix, hergestellt werden kann (Abb. 1 und 2) [1, 3]. Nach einmaliger Zentrifugation entsteht ein Konzentrat aus Thrombozyten, Leukozyten, Plasmaproteinen und Signalmolekülen, die in ein Fibringerüst eingebettet sind. Viele Studien konnten die Bioaktivität von PRF und seine Kapazität, unterschiedliche Wachstumsfaktoren freizusetzen, nachweisen. Wichtige Wachstumsfaktoren sind unter anderem: der Vascular Endothelial Growth Factor (VEGF), der für die Angiogenese und Vaskularisierung essenziell ist, der Epidermal Growth Factor (EGF), der eine wichtige Rolle in der Epithelialisierung spielt, sowie der Platelet-Derived Growth Factor (PDGF), der maßgeblich zur Wundheilung beiträgt [4, 5].
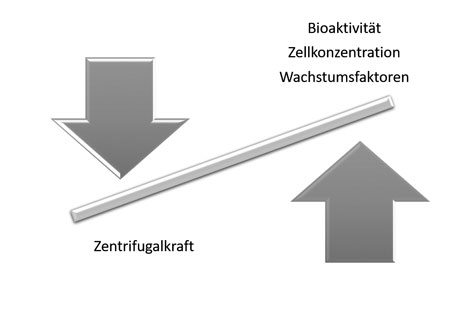
Bereits im Jahr 2014 konnten erste Untersuchungen zeigen, dass die Höhe der angewendeten Zentrifugalkraft während der Herstellung von Blutkonzentraten einen enormen Einfluss auf ihre Zusammensetzung, die Konzentration der darin eingeschlossenen Blutkomponenten und deren Bioaktivität hat. Daraufhin konnte das sogenannte Low Speed Centrifugation Concept (LSCC) beschrieben werden [1, 3]. Es besagt, dass Blutkonzentrate, die mittels einer hohen Zentrifugalkraft hergestellt werden, signifikant weniger Blutzellen (Thrombozyten und Leukozyten) enthalten und signifikant geringere Konzentrationen an Wachstumsfaktoren freisetzen können. Im Vergleich dazu steigt die Anzahl dieser Zellen und Wachstumsfaktoren bei einer niedrigen Zentrifugalkraft. Die Reduktion der angewendeten Zentrifugalkraft führt also zu einer bioaktiveren Matrix, die mit Blutzellen und deren Wachstumsfaktoren angereichert ist (Abb. 3) [1, 3].
Seit seiner Einführung hat der Einsatz von PRF nicht nur in der Implantologie und der MKPG, sondern auch in vielen weiteren Bereichen der regenerativen Medizin, wie Orthopädie, Unfallchirurgie, ästhetische Hautbehandlung und Sportmedizin an Bedeutung gewonnen [6–8].
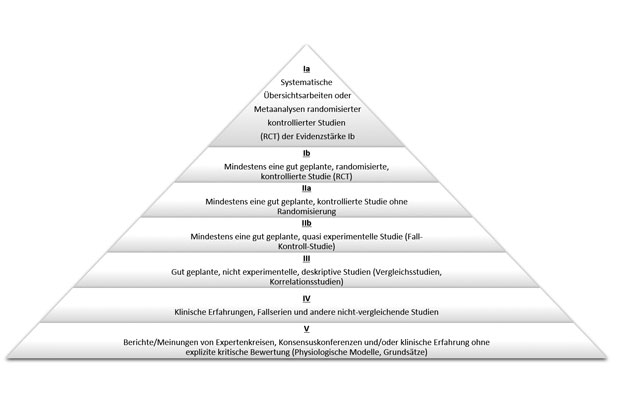
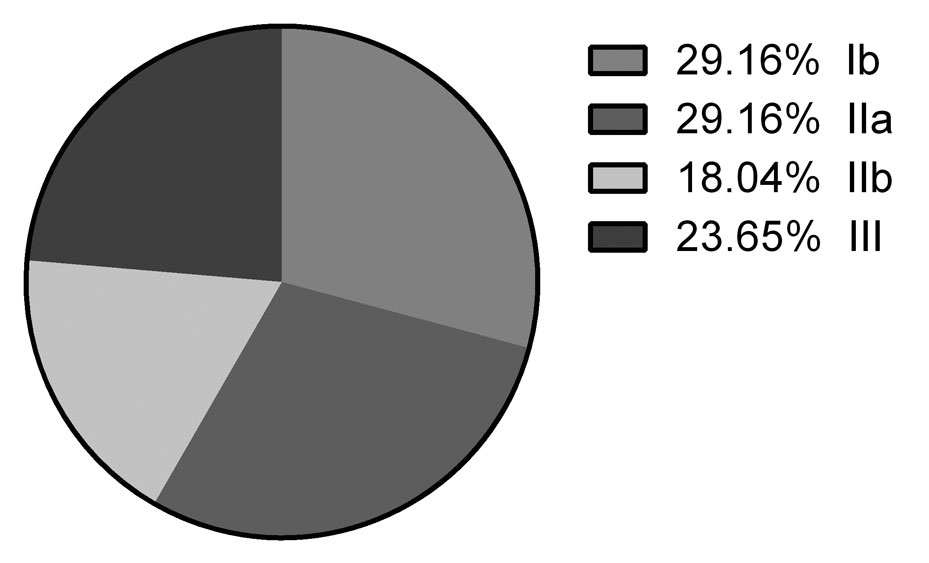
Der Einsatz von PRF wurde in unterschiedlichen Indikationen klinisch untersucht. Allerdings werden in der evidenzbasierten Medizin Beweiskräfte veröffentlichter Studien unterschieden. Dabei wird die Aussagekraft der Studie in Anlehnung an die Klassifikation nach der Empfehlung der US Agency of Healthcare and Quality in Evidenzklassen I–V eingeteilt (Abb. 4). Darüber hinaus werden die Forschungsergebnisse nach ihrer wissenschaftlichen Wertigkeit (Evidenzstärke) beurteilt [9]. Wichtige Parameter sind dabei vor allem der Studienplan, das Untersuchungsziel, die Konzeption der Studie, ob eine Kontrollgruppe mit Standardtherapie berücksichtigt wurde, und die Einteilung der Patienten in Untersuchungsgruppen nach dem Zufallsprinzip (Randomisierung). Nur durch solche Klassifikation ist es möglich, die klinische Evidenzstärke der Forschungsergebnisse zu beurteilen und eine geeignete und klinikrelevante Aussage zu treffen.
Ziel dieser Übersichtsarbeit war es, klinische Studien der vergangenen 15 Jahre, die den Einsatz von PRF in der Zahnmedizin und swe MKPG untersucht haben, nach Evidenzgrad zu klassifizieren, um einen Überblick über die vorhandene klinische Evidenz zu erhalten [10].
Literaturrecherche
Die systematische Literaturrecherche beschränkte sich auf klinische Studien, die in der Datenbank Pubmed bis Mai 2017 gelistet sind. Die Studien wurden von zwei unabhängigen Reviewern beurteilt und nach bestimmten Einschlusskriterien evaluiert. Von den gefundenen 392 Artikeln wurden 72 für die Analyse der Evidenzgrade weiterverwendet. Die Evidenzgrade wurden gemäß der Empfehlung der US Agency of Healthcare and Quality beurteilt.
Ergebnisse
Zunächst wurden die Studien nach ihrem Evidenzgrad evaluiert. 29,1 Prozent der 72 Studien waren mindestens gut geplante, randomisierte, kontrollierte Studien (RCT) und wurden dem Evidenzgrad Ib zugeordnet. Weitere 29,1 Prozent der Studien wurden als Evidenzgrad IIa klassifiziert, also mindestens als gut geplante, kontrollierte Studie ohne Randomisierung. 18 Prozent der Studien bildeten den Evidenzgrad IIb ab, das heißt mindestens eine gut geplante, quasi experimentelle Studie (Fallkontrollstudie). Weitere 23,6 Prozent waren gut geplante, nicht experimentelle, deskriptive Studien (Vergleichsstudien, Korrelationsstudien), die als Evidenzgrad III klassifiziert wurden, (siehe Abb. 4).
Im nächsten Schritt wurden die Studien nach ihren Einsatzgebiete eingeteilt. 40,2 Prozent der Studien untersuchten Fragestellungen der MKPG, 37,4 Prozent der Parodontologie, 13,8 Prozent der Implantologie und 8,3 Prozent der Endodontologie (Abb. 5). Im Folgenden wird auf die jeweiligen Einsatzgebiete im Detail eingegangen.
Endodontologie
Sechs Studien (eine Studie mit Evidenzgrad Ib [11] und fünf Studien mit Evidenzgrad III [12–16]) untersuchten den Einsatz von PRF zur Revaskularisierung der Pulpa und zur Regeneration periapikaler Knochendefekte. Fünf Studien waren Fallkontrollstudien mit Evidenzgrad III. Alle Studien berichteten, dass die Patienten nach der Behandlung mit PRF (Applikation von PRF in dem bereinigten Wurzelkanal) mit einer Nachverfolgung von sechs Monaten symptomfrei waren. Dabei wurde eine Revaskularisierung und Verdickung der Pulpawand beobachtet. Alle periapikalen Knochendefekte konnten regeneriert werden. Lediglich eine randomisierte kontrollierte Studie (Ib) [11] inkludierte 55 Patienten. Dabei wurde nekrotische Pulpitis mit Endo-Paro-Läsionen behandelt. Die Patienten in der PRF-Gruppe erhielten nach einer Kürettage des Defekts eine PRF-Behandlung und zeigten eine signifikante Verbesserung der Sondierungstiefen im Vergleich zur Kontrollgruppe (konventionelle Behandlung).
Parodontologie
26 Studien untersuchten den Einsatz von PRF in diversen Anwendungen zur Behandlung parodontaler Erkrankungen. Dabei war die chronische Parodontitis die am meisten untersuchte Erkrankung mit unterschiedlichen Knochenverlustgraden. Zwölf (Ib) Studien untersuchten den Einsatz von PRF in Kombination mit einer chirurgischen Lappenoperation im Vergleich zur Lappenoperation ohne PRF. Vier dieser Studien zeigten keinen signifikanten Unterschied für die Sondierungstiefen und Attachmentverluste [17–20]. Weitere sechs dieser Studien konnten eine signifikante Verbesserung der Sondierungstiefen und des Attachmentverlusts in der PRF-Gruppe im Vergleich zur Kontrollgruppe zeigen [6, 16, 21–24]. Zwei weitere Studien zeigten die Überlegenheit von PRF in der Schmerzreduktion, der Wundheilung und der Regeneration knöcherner Defekte im Vergleich zur Kontrollgruppe [25, 26].
Weitere 14 Studien (Evidenzgrad Ib und IIa) untersuchten die Kombination von PRF mit Biomaterialien im Vergleich zu Biomaterialien ohne PRF. Dabei wurden verschiedene Knochenersatzmaterialien in unterschiedlichen Studien verwendet. Neun dieser Studien zeigten eine statistisch signifikante Verbesserung in der PRF-Gruppe in Bezug auf Sondierungstiefen und Attachmentverlust im Vergleich zu Biomaterial ohne PRF [16, 27–32]. Zwei weitere Studien konnten keine signifikanten Unterschiede darlegen [19, 33].
Zwei Studien untersuchten die Kombination von PRF mit bioaktivem Hydroxylapatit für die Behandlung von Furkationsdefekten und konnten eine vielversprechende Verbesserung in der PRF-Gruppe zeigen [34, 35]. In einer weiteren Studie wurde PRF allein in der Testgruppe verwendet und in der Kontrollgruppe Eigenknochen für die Behandlung von parodontalen Defekten [35]. Es konnte kein signifikanter Unterschied zwischen den Untersuchungsgruppen beschrieben werden.
Der Einsatz von PRF wurde auch im Rahmen der kieferorthopädischen Behandlung zur Vermeidung von Dehiszenzen untersucht. Dabei wurden die Patienten mit PRF in Kombination mit einem Knochenersatzmaterial in einer Studie mit Evidenzgrad III behandelt [36]. Es wurde sowohl über eine verbesserte Wundheilung als auch über stabile Verhältnisse zwei Jahre nach der Behandlung berichtet.
Implantologie
In der Implantologie lag der Fokus der Studien auf der Erfolgsrate und der Osseointegration dentaler Implantate, deren Oberflächen mit PRF behandelt worden waren. In diesem Zusammenhang konnte eine Studie mit Evidenzgrad Ib zeigen, dass die Behandlung mit PRF die sekundäre Implantatstabilität im Vergleich zu Implantaten ohne PRF-Behandlung signifikant erhöht [37]. Eine weitere Studie mit Evidenzgrad Ib konnte einen statistisch signifikanten Unterschied in der periimplantären Knochenresorption darlegen [38]. Dabei zeigte die PRF-Gruppe im Vergleich zur Kontrollgruppe in den ersten drei Monaten signifikant weniger krestale Knochenresorption. Eine weitere Studie mit Evidenzgrad Ib untersuchte den Einfluss von PRF-Behandlungen während der Implantation auf die Osseointegration. Dazu konnten keine statistisch signifikanten Unterschiede im Vergleich zur Kontrollgruppe beschrieben werden [39]. Darüber hinaus untersuchte eine Studie mit Evidenzgrad IIa die Anwendung von PRF zur periimplantären Behandlung in Kombination mit einer Lappenoperation [40]. Dabei konnten signifikante Verbesserungen in der Sondierungstiefe in der PRF-Gruppe im Vergleich zur Kontrollgruppe erreicht werden. Eine weitere Studie (Evidenzgrad III) untersuchte die Implantatstabilität nach der Insertion in Alveolen, die mit PRF behandelt wurden, im Vergleich zu unbehandelten Alveolen. Die Ergebnisse brachten eine signifikant höhere Implantatstabilität in der PRF-Gruppe zutage [41].
Oralchirurgie, Mund-, Kiefer- und plastische Gesichtschirurgie
Im Bereich der Oral- und Kieferchirurgie wurden vor allem Studien evaluiert, die die präimplantologische Behandlung des atrophen Knochens untersucht haben.
Sinus Augmentation
Acht Studien untersuchten den Einsatz von PRF für die Behandlung atropher Oberkiefer mittels Sinusbodenelevation. In fünf Studien mit Evidenzgrad IIa wurde die Kombination von PRF mit Knochenersatzmaterialien im Vergleich zu Biomaterial ohne PRF untersucht. In allen Studien wurde von einer verbesserten Wundheilung in der PRF-Gruppe berichtet, aber von keinem signifikanten Unterschied in der Knochenneubildung zu den Untersuchungszeitpunkten [42–46]. In zwei Studien mit Evidenzgrad III wurde PRF als einziges Material für den Sinuslift verwendet, und es wurden keine Implantatverluste beobachtet [47, 48]. Allerdings fehlen in diesen Studien die entsprechenden Kontrollgruppen, um eine relevante Aussage treffen zu können. In einer weiteren Fallkontrollstudie mit Evidenzgrad IIb wurde die Kombination von PRF mit einem Knochenersatzmaterial untersucht. Die Ergebnisse zeigten eine Knochenregenregeneration von 31 Prozent [49].
Socket Preservation
Zwölf Studien (Evidenzgrad Ib und IIa) haben die Anwendung von PRF als Füllmaterial nach Zahnextraktion untersucht. Neun Studien davon (Evidenzgrad Ib und IIa) haben die Alveolenheilung mit PRF mit der physiologischen Alveolenheilung ohne PRF verglichen. In sechs dieser Studien konnten statistisch signifikant bessere Regenerationen in der PRF-Gruppe beobachtet werden [50–56]. Die Hauptparameter waren dabei die vertikale Knochendimension, die Kontur des Alveolarkamms und die Knochendichte. Demgegenüber konnten drei weitere Studien (Evidenzgrad III, IIa, IIb) keine signifikanten Unterschiede zwischen den Untersuchungsgruppen PRF versus physiologische Alveolenheilung darlegen [52, 57, 58].
Zwei Studien (Evidenzgrad IIa und IIb) untersuchten den Einfluss von PRF auf die Schmerzreduktion nach Zahnextraktion [57, 58]. Beide Studien bestätigten, dass PRF zu einer Schmerzreduktion führt, wobei der Unterschied nur in einer Studie statistisch signifikant im Vergleich zur Kontrollgruppe war [57]. Des Weiteren wurde PRF als Fibrinkleber in einer Studie untersucht. Dabei wurden 50 Patienten mit Antikoagulanzien-Therapie mit PRF nach der Extraktion von 168 Zähnen behandelt, um Nachblutungen zu vermeiden. 48 Patienten benötigten keine Nachbehandlung. Nur zwei Patienten mussten zusätzliche Blutstillung erhalten [59].
Ridge Augmentation
Eine Studie mit Evidenzgrad Ib untersuchte die Kombination von PRF mit Beckenkammtransplantation in Patienten mit behandelten Lippen-, Kiefer- und Gaumenspalten im Vergleich zur Beckenkammtransplantation ohne PRF. Die Ergebnisse zeigten eine statistisch signifikant höhere Knochenneubildungsrate in der PRF-Gruppe im Vergleich zur Kontrollgruppe [60].
PRF wurde in einer weiteren Studie mit Evidenzgrad III als Füllmaterial für Knochendefekte nach Zystektomie verwendet. Bereits nach drei Monaten konnte Knochenregeneration festgestellt und nach sechs Monaten konnte eine vollständige Regeneration der Defekte nachgewiesen werden [61].
Behandlung medikamentenassoziierter Kiefernekrose
Der Einsatz von PRF in der Behandlung von medikamentenassoziierten Kiefernekrosen wurde in fünf Studien untersucht. Zwei Studien mit dem Evidenzgrad IIa und IIb konnten eine signifikant schnellere und bessere Wundheilung in der PRF-Gruppe im Vergleich zum gleichen Eingriff ohne PRF zeigen [62, 63]. Dabei betrug die durchschnittliche Epithelialisierungsdauer in der PRF-Gruppe drei Wochen und in der Kontrollgruppe etwa fünf Wochen. Die weiteren drei Fallstudien haben positive klinische Beobachtungen berichtet [64–66]. Eine weitere interessante Untersuchung hat die Kombination von PRF mit BMP-2 im Vergleich zu PRF alleine in Patienten mit antiresorptiver Therapie evaluiert. Dabei konnte signifikant bessere Knochenheilung in der „BMP-2 plus PRF“-Gruppe im Vergleich zur Anwendung von PRF ohne BMP‑2 [62] festgestellt werden.
Diskussion und Schlussfolgerung
Blutkonzentrate, insbesondere das Platelet-Rich Fibrin (PRF) ist eine Quelle patienteneigener Regenerationskraft. Dabei werden für die Regeneration wichtige Bestandteile des peripheren Bluts durch Zentrifugation konzentriert [67]. PRF wird bei vielen unterschiedlichen Indikationen der regenerativen Medizin verwendet. Vor allem in der Zahnmedizin, der Oral- und der Kieferchirurgie findet PRF viele Einsatzgebiete, zum Beispiel in Endodontie, Parodontologie, Implantologie, präimplantotologischer Chirurgie und der Behandlung von medikamentenassoziierter Kiefernekrosen.
Ziel dieser systematischen Übersichtsarbeit war es, veröffentlichte klinische Studien der vergangenen 15 Jahre nach Evidenzgraden zu evaluieren, um einerseits herauszufinden, ob es möglich ist, eine Aussage hinsichtlich des Benefits von PRF zu treffen, und um andererseits zu evaluieren, bei welchen Indikationen der PRF-Einsatz vor allem der konventionellen Therapie überlegen ist [10].
Verständnis der regenerativen Mechanismen von PRF erlaubt dessen gezielte Anwendung in geeigneten Indikationen
Die Literaturrecherche ergab 72 Studien, die unterschiedliche Fragestellungen untersucht haben. Die meisten Studien wurden 2015–2017 publiziert. Randomisierte kontrollierte Studien waren in der Parodontologie am häufigsten vertreten. Insgesamt konnten diese Studien bestätigen, dass der Einsatz von PRF im Rahmen von Lappenoperationen die Sondierungstiefen und die Attachmentverluste signifikant verbessert im Vergleich zu Lappenoperationen ohne PRF. Ähnliche Ergebnisse wurden in der Alveolenregeneration nachgewiesen. Dabei zeigten sechs Studien mit hohen Evidenzgraden, dass die Alveolenheilung mit PRF signifikant bessere Regeneration gebracht hat im Vergleich zur physiologischen Alveolenheilung ohne PRF (Abb. 6 und 7). Auch in der Behandlung medikamentenassoziierter Kiefernekrosen konnten zwei Studien mit hohen Evidenzgraden nachweisen, dass Wundheilung und Epithelialisieung signifikant schneller und besser waren im Vergleich zur Behandlung ohne PRF (Abb. 8 und 9). Diese Ergebnisse betonen die klinisch relevanten Vorteile patienteneigener Blutkonzentrate in der Wundheilung und der Regeneration. Das Verständnis der regenerativen Mechanismen von Blutkonzentraten trägt maßgeblich dazu bei, geeignete klinische Indikationen zu finden, in denen der Einsatz der Blutkonzentrate tatsächlich bessere klinische Ergebnisse erzielt [5, 68, 69]. PRF besteht aus einem Fibringerüst, in das Plasma proteine, Blutzellen, also Thrombozyten, Leukozyten, und deren Subgruppen eingebettet sind [1]. Diese Zellen sind in der Lage, unterschiedliche Wachstumsfaktoren freizusetzen, die zur Vaskularisierung, Epithelialisierung und zur Wundheilung beitragen. Alle diese Elemente sind essenziell für eine erfolgreiche Geweberegenration [70]. PRF soll in der Klinik gezielt eingesetzt werden bei Indikationen, bei denen die Komponenten des PRFs und seine Bioaktivität zur besseren Wundheilung von Vorteil sind. Es sollte jedoch nicht erwartet werden, dass PRF als alleinige Maßnahme in allen Indikationen verwendet werden kann. Diese Annahme könnte in vielen Fälle irreführend sein.
Die Kombination von PRF mit Biomaterialien könnte deren Indikationsbereiche erweitern
In der präimplantologischen Kieferaugmentation sind je nach Fall unterschiedliche Defektmorphologien zu behandeln. Dabei ist die Stabilität des Augmentats für den Aufbau von großer Bedeutung; deshalb kann bei solchen Indikationen auf keinen Fall auf die Anwendung von Knochenersatzmaterialien verzichtet werden. Gewebe- und Knochenersatzmaterialien werden von unterschiedlichen Quellen gewonnen, die natürlicher (allogen = menschlich, xenogen = tierisch, phykogen = pflanzlich) oder synthetischer Herkunft sind. Vor allem natürliche Biomaterialien müssen strikte Reinigungs- und Prozessierungsschritte durchlaufen, um das Risiko einer überschießenden Immunantwort oder Abstoßungsreaktion möglichst gering zu halten [71]. Dabei werden alle biologisch aktiven Komponenten wie Zellen oder Signalmoleküle entfernt. Somit ist die Hauptaufgabe von Biomaterialien, eine stabile Leitstruktur für die Regeneration zu bilden. Sie können jedoch die Regeneration nicht aktiv unterstützen, da ihnen die zelluläre Komponente fehlt. Demgegenüber bietet PRF eine bioaktive Komponente, aber keinesfalls eine stabile Struktur vergleichbar mit Knochenersatzmaterialien. Es sollte nicht erwartet werden, dass durch die Anwendung von PRF die Aufgaben des Knochenersatzmaterials ersetzt werden können. Deshalb ist die Kombination von PRF und Biomaterialien eine wichtige und sinnvolle Methode. Dabei könnten Biomaterialien biologisiert werden, um ihre regenerative Kapazität zu unterstützen. Nur so ist es möglich, alle Komponenten, die für die Augmentation notwendig sind, dem Körper zur Verfügung zu stellen und damit die biomaterialbasierte Regeneration zu beschleunigen. Auch könnte die Benetzung der Implantatoberfläche mit PRF zu einer Beschleunigung der Osseointegration führen (Abb. 10).
Randomisierte kontrollierte Studien im Bereich der Parodontologie haben nachgewiesen, dass die Kombination von PRF und Biomaterialien der Behandlung mit dem alleinigen Biomaterial überlegen war. Des Weiteren konnten mit der Kombination von PRF mit einem Knochenersatzmaterial und einem Titangitter dreidimensionale Augmentationen in ehemaligen Tumorpatienten erfolgreich durchgeführt werden. So konnte bei diesem speziellen Patientenkollektiv sogar auf die autologe Knochentransplantation verzichtet werden [72]. Diese Ergebnisse zeigen, dass sich durch die Kombination des bioaktiven autologen PRF mit Knochenersatzmaterialien, die Indikationsgebiete der Biomaterialien sogar erweitern können und immer mehr Patienten mit minimalinvasiven Maßnahmen erfolgreich behandelt werden könnten. Im Bereich der Sinusaugmentation, der komplexen Kieferaugmentation und der Osseointegration dentaler Implantate sind nur wenige Studien vorhanden, die teilweise kontroverse Ergebnisse berichtet haben. Außerdem sind bisher keine Studien vorhanden, die den Einfluss von PRF in der Periimplantitistherapie untersucht haben. Aufbauend auf den positiven Ergebnissen der Studien in der Parodontaltherapie, könnte der Einsatz von PRF in der Periimplantitistherapie vielversprechend sein.
Systematische Herstellungsprotokolle sollen reproduzierbaren klinischen Erfolg gewährleisten
Interessanterweise wurden in der vorliegenden Übersichtsarbeit viele unterschiedliche Zentrifugationsprotokolle in den unterschiedlichen Studien verwendet, sodass die Reproduzierbarkeit der Ergebnisse kaum möglich ist. Es gibt in der Literatur keine standardisierten Protokolle zur Herstellung und Verarbeitung von PRF. Das war auch der Grund, warum in der vorliegenden Übersichtsarbeit keine Metaanalyse möglich war.
Seit mehreren Jahren beschäftigt sich unsere Arbeitsgruppe mit dem Verständnis der Herstellung von Blutkonzentraten und dem Einfluss der angewendeten Zentrifugalkraft auf die Bioaktivität und die Zusammensetzung von PRF. Es konnte in mehreren Studien nachgewiesen werden, dass die angewendete Zentrifugalkraft einen enormen Einfluss auf die Zusammensetzung und die Bioaktivität von PRF ausübt [1, 4, 69, 70, 73, 74]. Darauf aufbauend wurde das Low Speed Centrifugation Concept (LSCC) eingeführt [70].
Das Konzept strebt eine Standardisierung der Herstellungsprotokolle von PRF an. Es konnte nachgewiesen werden, dass die Anwendung einer niedrigen Zentrifugalkraft eine signifikant höhere Anzahl an Thrombozyten und Leukozyten in dem PRF ergibt im Vergleich zu PRF-Matrizen, die mittels einer hohen Zentrifugalkraft hergestellt wurden. Auch die Wachstumsfaktorfreisetzung war signifikant höher in PRF-Matrizen, die mit einer niedrigen Zentrifugalkraft hergestellt wurden im Vergleich zu solchen, die mit einer hohen Zentrifugalkraft hergestellt wurden.
Systematische Protokolle, die auf alle programmierbaren Zentrifugen anwendbar sind, sollen Klinikern eine Möglichkeit geben, reproduzierbare klinische Ergebnisse zu erzielen (Tabelle 1). Es muss beachtet werden, dass die Zentrifugalkraft der wichtigste Parameter für den Herstellungsprozess ist. Dieser errechnet sich aus den auf der Zentrifuge einstellbaren „Umdrehungen pro Minute“ und dem Zentrifugenradius.
Außerdem muss betont werden, dass es weiterhin an klinischen Studien mit hohem Evidenzgrad mangelt. Bei der Verwendung von Forschungsergebnissen muss unbedingt die Aussagekraft der Studie beachtet werden. Darüber hinaus werden laufende kontrollierte randomisierte klinische Studien, die einen hohen Evidenzgrad liefern, herausfinden, welches Zentrifugationsprotokoll sich für welche Indikation am ehesten eignet.
Literaturverzeichnis unter www.teamwork-media.de/literatur
| Protokoll | Zentrifugalkraft | Umdrehungen pro Minute (UpM) bei Zentrifugenradius von 110 mm | Zeit |
| PRF-High | 710 | 2400 | 8 |
| PRF-Medium PRF-Low | 177 44 | 1200 600 | 8 8 |
Fachbericht
Weitere Beiträge zum Thema